Menguasai Hukum Proust: Contoh Soal dan Pembahasan Lengkap
Oke, siap! Berikut adalah konten artikel yang dioptimalkan SEO tentang contoh soal hukum Proust, ditulis dalam bahasa Indonesia yang baik dan benar, serta mengikuti semua instruksi yang telah diberikan:
Preview Konten: Bingung dengan Hukum Proust? Artikel ini menyajikan contoh soal Hukum Proust yang akan membantu Anda memahaminya. Simak pembahasan lengkap dan kuasai konsepnya!
Apa Itu Hukum Proust dan Mengapa Penting?
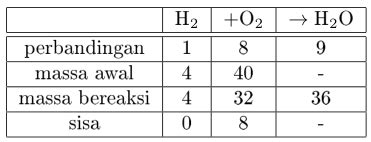
Hukum Proust, juga dikenal sebagai Hukum Perbandingan Tetap, adalah salah satu pilar penting dalam ilmu kimia. Hukum ini menyatakan bahwa suatu senyawa kimia selalu mengandung unsur-unsur yang sama dalam perbandingan massa yang tetap, tanpa bergantung pada asal senyawa tersebut atau cara pembuatannya. Memahami hukum ini sangat krusial karena menjadi dasar bagi perhitungan stoikiometri dan pemahaman komposisi senyawa.
Contoh Soal Hukum Proust: Aplikasi dalam Perhitungan
Berikut adalah beberapa contoh soal Hukum Proust yang akan membantu Anda memahami bagaimana hukum ini diterapkan dalam perhitungan kimia:
Contoh Soal 1: Analisis Perbandingan Massa
Soal: Suatu sampel senyawa tembaga(II) oksida (CuO) mengandung 63,5 gram tembaga dan 16 gram oksigen. Jika sampel lain dari senyawa yang sama mengandung 127 gram tembaga, berapa gram oksigen yang terkandung dalam sampel tersebut?
Pembahasan:
- Hitung perbandingan massa Cu:O pada sampel pertama: 63,5 gram Cu : 16 gram O
- Sederhanakan perbandingan: Bagi kedua sisi dengan 16, sehingga menjadi 3,97 : 1 (mendekati 4:1 untuk kemudahan perhitungan)
- Terapkan perbandingan pada sampel kedua: Jika ada 127 gram Cu, maka gram oksigen dapat dihitung dengan 127 gram Cu / 4 = 31,75 gram O
- Jawaban: Sampel kedua mengandung 31,75 gram oksigen.
- Hitung massa oksigen dalam 2 gram MgO: Massa Oksigen = Massa MgO - Massa Mg = 2 gram - 1,2 gram = 0,8 gram
- Hitung perbandingan massa Mg:O: 1,2 gram Mg : 0,8 gram O
- Sederhanakan perbandingan: Bagi kedua sisi dengan 0,8, sehingga menjadi 1,5 : 1
- Hitung massa oksigen dalam 5 gram MgO:
- Jawaban: 5 gram senyawa MgO mengandung 2 gram oksigen.
- Hitung massa oksigen yang bereaksi: Massa Oksigen = Massa FexOy - Massa Fe = 5,72 gram - 4 gram = 1,72 gram
- Ubah massa menjadi mol:
- Cari perbandingan mol Fe:O: 0,071 : 0,1075
- Sederhanakan perbandingan: Bagi kedua sisi dengan 0,071, sehingga menjadi 1 : 1,5 (atau 2 : 3 jika dikalikan 2)
- Rumus Empiris: Fe2O3
- Pahami Konsep Dasar: Pastikan Anda benar-benar memahami definisi dan implikasi Hukum Proust.
- Identifikasi Senyawa: Perhatikan senyawa yang terlibat dalam soal dan pastikan Anda memahami komposisinya.
- Gunakan Perbandingan: Hukum Proust menekankan pada perbandingan massa yang tetap. Gunakan perbandingan ini untuk menyelesaikan soal.
- Latihan Soal: Semakin banyak Anda berlatih, semakin mahir Anda dalam mengerjakan soal Hukum Proust.
Contoh Soal 2: Menentukan Massa Unsur dalam Senyawa
Soal: Seorang analis kimia menemukan bahwa 2 gram senyawa magnesium oksida (MgO) mengandung 1,2 gram magnesium. Berapa gram oksigen yang terkandung dalam 5 gram senyawa yang sama?
Pembahasan:
* Perbandingan massa tetap: 1,5 Mg : 1 O
Jika massa MgO adalah 5 gram, maka massa Mg adalah (1,5 / (1,5+1)) 5 gram = 3 gram
* Massa O = Massa MgO - Massa Mg = 5 gram - 3 gram = 2 gram
Contoh Soal 3: Penerapan Hukum Proust dalam Reaksi Kimia
Soal: 4 gram logam besi (Fe) bereaksi dengan oksigen (O2) menghasilkan 5,72 gram besi oksida (FexOy). Tentukan rumus empiris senyawa besi oksida tersebut. (Petunjuk: Gunakan massa atom relatif Fe = 56 dan O = 16)
Pembahasan:
* Mol Fe = 4 gram / 56 g/mol = 0,071 mol
* Mol O = 1,72 gram / 16 g/mol = 0,1075 mol
Tips dan Trik Mengerjakan Soal Hukum Proust
Kesimpulan
Memahami contoh soal Hukum Proust adalah kunci untuk menguasai konsep perbandingan tetap dalam kimia. Dengan latihan yang cukup dan pemahaman yang mendalam, Anda akan mampu menyelesaikan berbagai jenis soal terkait Hukum Proust dengan mudah. Jangan ragu untuk mencari sumber belajar tambahan dan berdiskusi dengan teman atau guru jika Anda mengalami kesulitan.
Tanya Jawab (Q&A) tentang Hukum Proust
Q: Apa perbedaan Hukum Proust dengan Hukum Dalton?
A: Hukum Proust (Hukum Perbandingan Tetap) fokus pada perbandingan massa unsur-unsur dalam suatu senyawa yang selalu tetap, sedangkan Hukum Dalton (Hukum Kelipatan Perbandingan) membahas perbandingan massa unsur-unsur yang sama dalam beberapa senyawa yang berbeda.
Q: Apakah Hukum Proust selalu berlaku untuk semua senyawa?
A: Hukum Proust umumnya berlaku untuk senyawa kimia, namun ada pengecualian untuk senyawa non-stoikiometri, di mana perbandingan unsur-unsurnya dapat sedikit bervariasi.
Q: Bagaimana cara menggunakan Hukum Proust dalam perhitungan stoikiometri?
A: Hukum Proust membantu menentukan perbandingan massa unsur-unsur dalam suatu senyawa, yang kemudian dapat digunakan untuk menghitung massa reaktan dan produk dalam reaksi kimia.
Semoga artikel ini bermanfaat! Jika Anda memiliki pertanyaan lebih lanjut, jangan ragu untuk bertanya. Selamat belajar!





