Contoh Soal Kesetimbangan Kimia: Panduan Lengkap dan Pembahasan Tuntas
Baik, berikut adalah konten artikel mengenai contoh soal kesetimbangan kimia yang dioptimalkan SEO, dengan format Markdown, dan ditulis dalam Bahasa Indonesia yang baik dan benar:
Kesetimbangan kimia adalah kondisi dinamis saat laju reaksi maju sama dengan laju reaksi balik. Konsep ini penting dalam kimia, dan pemahaman mendalam sangat diperlukan. Artikel ini akan membahas berbagai contoh soal kesetimbangan kimia beserta pembahasannya, membantu Anda memahami konsep dan meningkatkan kemampuan problem-solving. Mari kita mulai!
Apa Itu Kesetimbangan Kimia?
Sebelum menyelami contoh soal kesetimbangan kimia, mari kita pahami dulu definisinya. Kesetimbangan kimia tercapai ketika:
- Laju reaksi maju (pembentukan produk) sama dengan laju reaksi balik (pembentukan reaktan).
- Konsentrasi reaktan dan produk tetap konstan seiring waktu.
- Sistem bersifat dinamis, artinya reaksi terus berlangsung meskipun tidak ada perubahan makroskopis yang teramati.
- Konsentrasi: Menambah konsentrasi reaktan akan menggeser kesetimbangan ke arah produk, dan sebaliknya.
- Tekanan: Perubahan tekanan berpengaruh signifikan pada sistem kesetimbangan yang melibatkan gas. Menaikkan tekanan akan menggeser kesetimbangan ke arah sisi dengan jumlah mol gas yang lebih sedikit, dan sebaliknya.
- Suhu: Reaksi endotermik (menyerap panas) kesetimbangannya akan bergeser ke arah produk saat suhu dinaikkan. Reaksi eksotermik (melepas panas) kesetimbangannya akan bergeser ke arah reaktan saat suhu dinaikkan.
- Volume: Perubahan volume berpengaruh signifikan pada sistem kesetimbangan yang melibatkan gas. Mengurangi volume akan menggeser kesetimbangan ke arah sisi dengan jumlah mol gas yang lebih sedikit, dan sebaliknya.
- [NH3] = 0,2 mol / 1 L = 0,2 M
- [N2] = 0,5 mol / 1 L = 0,5 M
- [H2] = 0,3 mol / 1 L = 0,3 M
- R = Konstanta gas ideal (0,0821 L atm / mol K)
- T = Suhu dalam Kelvin
- Δn = Perubahan jumlah mol gas (mol produk - mol reaktan)
- Pahami Konsep Dasar: Pastikan Anda memahami definisi kesetimbangan kimia, faktor-faktor yang mempengaruhinya, dan hukum aksi massa.
- Tulis Persamaan Reaksi Setara: Pastikan persamaan reaksi sudah setara sebelum menghitung Kc atau Kp.
- Gunakan Tabel ICE (Initial, Change, Equilibrium): Tabel ICE membantu Anda melacak perubahan konsentrasi reaktan dan produk selama reaksi mencapai kesetimbangan.
- Perhatikan Satuan: Pastikan Anda menggunakan satuan yang tepat saat menghitung Kc atau Kp.
- Latihan Soal: Semakin banyak Anda berlatih soal, semakin mahir Anda dalam memecahkan masalah kesetimbangan kimia.
Faktor-Faktor yang Mempengaruhi Kesetimbangan Kimia
Prinsip Le Chatelier menyatakan bahwa jika suatu perubahan kondisi diterapkan pada sistem kesetimbangan, sistem akan bergeser untuk mengurangi efek perubahan tersebut. Faktor-faktor yang mempengaruhi kesetimbangan kimia meliputi:
Contoh Soal Kesetimbangan Kimia dan Pembahasannya
Berikut adalah beberapa contoh soal kesetimbangan kimia yang sering muncul, beserta pembahasannya:
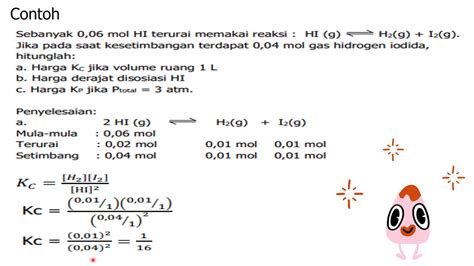
Contoh Soal 1: Menentukan Nilai Kc
Soal:
Dalam wadah 1 liter, terdapat kesetimbangan:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Pada saat setimbang, terdapat 0,5 mol N2, 0,3 mol H2, dan 0,2 mol NH3. Hitunglah nilai Kc!
Pembahasan:
Kc adalah konstanta kesetimbangan berdasarkan konsentrasi. Rumusnya adalah:
Kc = [NH3]2 / ([N2] x [H2]3)
Kc = (0,2)2 / (0,5 x (0,3)3) = 2,96
Jadi, nilai Kc untuk reaksi tersebut adalah 2,96.
Contoh Soal 2: Pengaruh Perubahan Konsentrasi
Soal:
Reaksi kesetimbangan:
2SO2(g) + O2(g) ⇌ 2SO3(g)
Jika pada kondisi setimbang, konsentrasi SO2 ditingkatkan, ke arah manakah kesetimbangan akan bergeser?
Pembahasan:
Menurut Prinsip Le Chatelier, jika konsentrasi SO2 ditingkatkan, kesetimbangan akan bergeser ke arah kanan (pembentukan SO3) untuk mengurangi efek peningkatan konsentrasi SO2.
Contoh Soal 3: Pengaruh Perubahan Tekanan
Soal:
Reaksi kesetimbangan:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Jika tekanan sistem ditingkatkan, ke arah manakah kesetimbangan akan bergeser?
Pembahasan:
Pada reaksi ini, jumlah mol gas di sisi kiri adalah 4 (1 mol N2 + 3 mol H2), sedangkan di sisi kanan adalah 2 (2 mol NH3). Karena peningkatan tekanan akan menggeser kesetimbangan ke arah sisi dengan jumlah mol gas yang lebih sedikit, maka kesetimbangan akan bergeser ke arah kanan (pembentukan NH3).
Contoh Soal 4: Menghitung Kp dari Kc
Soal:
Diketahui reaksi kesetimbangan:
CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
Pada suhu 700 K, nilai Kc adalah 5,10. Hitunglah nilai Kp!
Pembahasan:
Hubungan antara Kp dan Kc adalah:
Kp = Kc (RT)Δn
Dimana:
Dalam reaksi ini, Δn = (1 + 1) - (1 + 1) = 0
Jadi, Kp = Kc (RT)0 = Kc = 5,10
Nilai Kp adalah 5,10.
Contoh Soal 5: Memprediksi Arah Pergeseran Kesetimbangan Berdasarkan Nilai Q
Soal:
Untuk reaksi:
2SO2(g) + O2(g) ⇌ 2SO3(g)
Kc = 4.32 pada 300°C. Dalam campuran tertentu, tekanan parsial SO2 adalah 0.200 atm, O2 adalah 0.100 atm, dan SO3 adalah 0.400 atm. Prediksikan arah pergeseran kesetimbangan.
Pembahasan:
Hitung kuosien reaksi, Q:
Q = (PSO3)2 / ((PSO2)2 (PO2)) = (0.400)2 / ((0.200)2 (0.100)) = 40
Karena Q > Kc (40 > 4.32), reaksi akan bergeser ke kiri (ke arah reaktan) untuk mencapai kesetimbangan.
Tips dan Trik Mengerjakan Soal Kesetimbangan Kimia
Kesimpulan
Memahami contoh soal kesetimbangan kimia adalah kunci untuk menguasai konsep ini. Dengan memahami prinsip dasar, faktor-faktor yang mempengaruhi kesetimbangan, dan rajin berlatih, Anda akan mampu memecahkan berbagai soal kesetimbangan kimia dengan mudah. Semoga artikel ini bermanfaat!
Tanya Jawab Seputar Kesetimbangan Kimia
T: Apa perbedaan antara Kc dan Kp?
J: Kc adalah konstanta kesetimbangan berdasarkan konsentrasi molar, sedangkan Kp adalah konstanta kesetimbangan berdasarkan tekanan parsial. Keduanya terkait melalui persamaan: Kp = Kc(RT)^Δn
T: Mengapa kesetimbangan kimia dikatakan dinamis?
J: Karena meskipun konsentrasi reaktan dan produk terlihat konstan, reaksi maju dan balik terus berlangsung dengan laju yang sama.
T: Apa pengaruh katalis terhadap kesetimbangan kimia?
J: Katalis tidak mempengaruhi posisi kesetimbangan, tetapi mempercepat tercapainya kesetimbangan dengan menurunkan energi aktivasi reaksi maju dan balik secara bersamaan.
T: Bagaimana cara memprediksi arah pergeseran kesetimbangan?
J: Gunakan Prinsip Le Chatelier. Sistem akan bergeser untuk mengurangi efek perubahan kondisi (konsentrasi, tekanan, suhu, volume). Selain itu bisa juga menggunakan Kuosien reaksi (Q) dengan membandingkan nilainya terhadap Kc untuk menentukan arah pergeseran kesetimbangan. Jika Q < Kc, reaksi bergeser ke kanan (produk). Jika Q > Kc, reaksi bergeser ke kiri (reaktan). Jika Q = Kc, sistem berada dalam kesetimbangan.
T: Mengapa penting memahami kesetimbangan kimia?
J: Kesetimbangan kimia penting dalam berbagai bidang, termasuk industri kimia (untuk mengoptimalkan hasil produksi), biologi (dalam reaksi enzimatis), dan lingkungan (dalam memahami polusi udara dan air).