Contoh Soal Hukum Hess: Panduan Lengkap dengan Pembahasan
Oke, siap! Berikut adalah konten artikel tentang contoh soal Hukum Hess yang dioptimalkan SEO dan ramah pembaca:
Preview: Bingung dengan Hukum Hess? Artikel ini akan memandu Anda memahami konsep Hukum Hess melalui contoh soal Hukum Hess yang mudah dipahami. Mari kita pecahkan bersama!
Apa Itu Hukum Hess? (dan Mengapa Penting?)
Hukum Hess, atau Hukum Penjumlahan Kalor Hess, menyatakan bahwa perubahan entalpi (ΔH) dalam suatu reaksi kimia hanya bergantung pada keadaan awal dan keadaan akhir reaksi, dan tidak bergantung pada jalur atau tahapan reaksi. Dengan kata lain, perubahan entalpi adalah fungsi keadaan. Hukum ini sangat penting dalam termokimia karena memungkinkan kita menghitung perubahan entalpi reaksi yang sulit diukur secara langsung.
Mengapa Kita Perlu Contoh Soal Hukum Hess?
Memahami teori saja tidak cukup. Dengan mempelajari contoh soal Hukum Hess, kita dapat mengaplikasikan teori tersebut dan melihat bagaimana Hukum Hess bekerja dalam praktik. Contoh soal membantu kita memvisualisasikan konsep, mengidentifikasi pola, dan mengembangkan keterampilan pemecahan masalah.
Contoh Soal Hukum Hess Beserta Pembahasan
Berikut adalah beberapa contoh soal Hukum Hess yang akan membantu Anda memahami konsep ini lebih dalam.
Contoh Soal 1:
Diketahui:
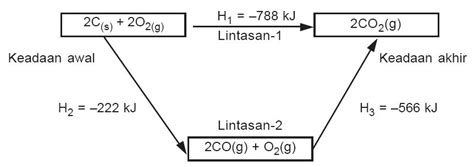
- Reaksi 1: C(s) + O₂(g) → CO₂(g) ΔH₁ = -393.5 kJ
- Reaksi 2: CO(g) + ½O₂(g) → CO₂(g) ΔH₂ = -283.0 kJ
- C(s) + ½O₂(g) → CO(g)
- Perhatikan reaksi 1: C(s) + O₂(g) → CO₂(g) ΔH₁ = -393.5 kJ. Reaksi ini sudah memiliki C(s) sebagai reaktan. Kita biarkan reaksi ini seperti apa adanya.
- Perhatikan reaksi 2: CO(g) + ½O₂(g) → CO₂(g) ΔH₂ = -283.0 kJ. Kita ingin CO(g) menjadi produk, bukan reaktan. Jadi, kita balik reaksi ini:
- Sekarang, jumlahkan kedua reaksi tersebut:
- 2H₂(g) + O₂(g) → 2H₂O(l) ΔH = -572 kJ
- N₂(g) + 3H₂(g) → 2NH₃(g) ΔH = -92 kJ
- N₂(g) + O₂(g) → 2NO(g) ΔH = +180 kJ
- Target kita punya 4NH₃ sebagai reaktan. Kita perlu reaksi yang memiliki NH₃ dan kita perlu mengalikannya dengan 2 dan membaliknya. Jadi reaksi kedua menjadi:
- Target kita punya 4NO sebagai produk. Reaksi ketiga sudah memiliki NO sebagai produk. Kita perlu mengalikannya dengan 2:
- Target kita punya 6H₂O sebagai produk. Reaksi pertama sudah memiliki H₂O sebagai produk. Kita perlu mengalikannya dengan 3:
- Jumlahkan ketiga reaksi yang telah dimodifikasi:
- Identifikasi Reaksi Target: Pahami reaksi yang ingin Anda cari perubahan entalpinya.
- Manipulasi Reaksi Diketahui: Balikkan atau kalikan reaksi yang diketahui sehingga reaktan dan produk sesuai dengan reaksi target. Ingat untuk menyesuaikan nilai ΔH.
- Eliminasi Zat yang Tidak Diperlukan: Pastikan zat yang tidak ada dalam reaksi target saling menghilangkan ketika reaksi dijumlahkan.
- Periksa Kembali: Pastikan semua zat dan koefisien stoikiometri sudah sesuai dengan reaksi target.
- Soal Dasar: Menentukan ΔH reaksi target dengan manipulasi langsung dari reaksi yang diketahui.
- Soal Intermediate: Membutuhkan beberapa langkah manipulasi dan melibatkan lebih banyak reaksi.
- Soal Aplikasi: Menghubungkan Hukum Hess dengan konsep termokimia lainnya, seperti energi ikatan atau kalor pembentukan.
Hitung ΔH untuk reaksi:
Pembahasan:
Tujuan kita adalah mendapatkan reaksi target: C(s) + ½O₂(g) → CO(g)
CO₂(g) → CO(g) + ½O₂(g) ΔH₂' = +283.0 kJ (Perhatikan tanda ΔH berubah)
C(s) + O₂(g) → CO₂(g) ΔH₁ = -393.5 kJ
CO₂(g) → CO(g) + ½O₂(g) ΔH₂' = +283.0 kJ
--------------------------------------------- +
C(s) + ½O₂(g) → CO(g) ΔH = ΔH₁ + ΔH₂' = -393.5 kJ + 283.0 kJ = -110.5 kJ
Jadi, ΔH untuk reaksi C(s) + ½O₂(g) → CO(g) adalah -110.5 kJ.
Contoh Soal 2:
Diketahui:
Hitung ΔH untuk reaksi:
4NH₃(g) + 5O₂(g) → 4NO(g) + 6H₂O(l)
Pembahasan:
Ini adalah contoh soal yang lebih kompleks. Kita perlu memanipulasi ketiga reaksi yang diberikan untuk mendapatkan reaksi target.
4NH₃(g) → 2N₂(g) + 6H₂(g) ΔH = +184 kJ (Dikali 2 dan dibalik)
2N₂(g) + 2O₂(g) → 4NO(g) ΔH = +360 kJ (Dikali 2)
6H₂(g) + 3O₂(g) → 6H₂O(l) ΔH = -1716 kJ (Dikali 3)
4NH₃(g) → 2N₂(g) + 6H₂(g) ΔH = +184 kJ
2N₂(g) + 2O₂(g) → 4NO(g) ΔH = +360 kJ
6H₂(g) + 3O₂(g) → 6H₂O(l) ΔH = -1716 kJ
--------------------------------------------- +
4NH₃(g) + 5O₂(g) → 4NO(g) + 6H₂O(l) ΔH = +184 + 360 - 1716 = -1172 kJ
Jadi, ΔH untuk reaksi 4NH₃(g) + 5O₂(g) → 4NO(g) + 6H₂O(l) adalah -1172 kJ.
Penting: Perhatikan bagaimana tanda ΔH berubah ketika reaksi dibalik dan bagaimana kita mengalikan ΔH ketika reaksi dikalikan dengan suatu koefisien.
Tips & Trik Mengerjakan Soal Hukum Hess
Kategori Soal Hukum Hess
Soal Hukum Hess bisa bervariasi, tetapi umumnya terbagi menjadi beberapa kategori:
Tren Terkini dalam Pembelajaran Hukum Hess
Pembelajaran Hukum Hess kini semakin terbantu dengan adanya simulasi interaktif dan video pembelajaran online. Sumber daya ini memungkinkan siswa untuk memvisualisasikan konsep dan melatih keterampilan pemecahan masalah secara mandiri.
Tautan Internal
Untuk pemahaman lebih lanjut tentang termokimia, Anda bisa membaca artikel kami tentang Kalorimeter: Pengukuran Kalor Reaksi.
Tanya Jawab Seputar Hukum Hess
T: Mengapa Hukum Hess Penting?
J: Hukum Hess memungkinkan kita menghitung perubahan entalpi untuk reaksi yang sulit atau tidak mungkin diukur secara langsung. Ini sangat penting dalam berbagai aplikasi, seperti perancangan proses kimia dan analisis termodinamika.
T: Apa yang Terjadi pada ΔH Jika Reaksi Dibalik?
J: Jika reaksi dibalik, tanda ΔH juga berubah. Jika ΔH awalnya positif (endotermik), maka menjadi negatif (eksotermik) dan sebaliknya.
T: Apa yang Terjadi pada ΔH Jika Reaksi Dikalikan?
A: Jika reaksi dikalikan dengan suatu koefisien, maka nilai ΔH juga harus dikalikan dengan koefisien yang sama.
T: Bagaimana Cara Mengetahui Reaksi Mana yang Harus Dibalik atau Dikalikan?
A: Perhatikan reaksi target dan bandingkan dengan reaksi yang diketahui. Sesuaikan reaksi yang diketahui agar reaktan dan produknya sesuai dengan reaksi target.
Semoga artikel ini membantu Anda memahami contoh soal Hukum Hess dan konsep Hukum Hess secara keseluruhan. Selamat belajar!